撰文 | clefable
审校 | 黄雨佳
很久之前,一些单细胞生物选择了多细胞的命运,它们一代代演化才有了如今丰富多彩的生物。但如今,在人这样的多细胞生物中,如果有任何一个细胞想重新回到曾自由生长、无限分裂的“细菌身份”——变成癌细胞,生物体都会设法将其清除。
多细胞生命无法承受由癌细胞不断扩增带来的崩溃和混乱,因此所有细胞都会受到精密的调控。不过在这样的情况下,一些特定的细胞也实现了个体寿命的最大化。例如,一些胚胎干细胞和神经元几乎就会伴随我们终身。除此之外,初级卵母细胞、记忆T细胞和记忆B细胞也有长达数十年的寿命。
这些细胞的长寿得益于不同的调控方式。2020年,一项发表于《神经元》(Neuron)的研究发现,神经元的长寿可归因于它们对“细胞凋亡”不敏感。它们即便遇到了各种压力,也不会自发死亡。这也保证了动物体可以稳定地履行各项生理功能,包括呼吸、进食、运动、记忆和认知等。
西班牙巴塞罗那基因组调控中心的分子生物学家埃尔万·博克(Elvan Böke)则一直对指存在于女性体内,拥有甚至长达50多年寿命的初级卵母细胞十分好奇。
保持稚嫩,才有稚嫩的后代
精子和卵子会结合形成受精卵,孕育一个新的生命,但两者最初产生的过程却非常不同。它们都需要由初始的生殖细胞经过两次减数分裂形成。在一位性成熟的男性体内,精原干细胞会不断地增殖、分化成成熟的精子,整个过程大概需要大约2个月的时间。而一颗卵子的成熟就比较曲折和漫长:到初级卵母细胞这一步时,这些细胞会停在第一次减数分裂前期长达十多年,甚至50多年的时间。在漫长的“停滞”期,这些初级卵母细胞看似在休眠,但仍保持着代谢活性。
不知道你是否困惑过一个显而易见的现象:为何那些人到壮年、已经有些衰老的雄性和雌性,却可以孕育出新的生命,仿佛壮年的细胞又回到了生命的起点?或者说,为何由受精卵发育的后代,并不会继承父母已有的衰老状态?
一个受精卵会继承父亲的一个精子的细胞核和母亲的一个完整的卵子(包括细胞核和细胞质及其中所有细胞器等)。考虑到后代中所有细胞的细胞质都来源于这颗特别的卵子,博克认为卵子一定有特别的方法,能维持在一个健康的状态,避免由代谢导致的损伤积累,尤其是在漫长的初级卵母细胞时期。
此前的研究发现,线粒体活动产生的副产物活性氧(ROS)有可能会导致受精率和胚胎的存活率降低。2022年,在一项发表于《自然》(Nature)的论文中,博克等人分别研究了非洲爪蟾的I期卵母细胞(在非洲爪蟾中,卵子的发育有5个阶段)和人的初级卵母细胞。他们在这两种细胞中,均没有检测到任何的ROS信号。与之相对的,卵母细胞周围的非生殖细胞则有ROS信号。
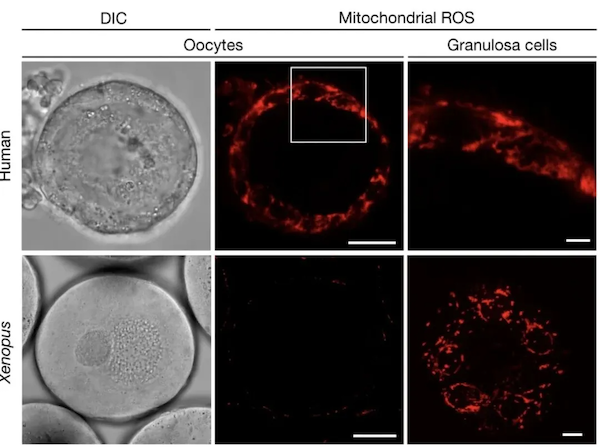
他们用甲萘醌(会促使细胞产生ROS)处理了非洲爪蟾的I期卵母细胞,结果发现78.3%的细胞在经处理放置过夜后会死亡,而抗氧化剂可以拯救它们。这也表明,这些卵母细胞需要控制体内的ROS水平,不然就会死亡。
想要控制细胞内的ROS水平,就需要控制线粒体上的氧化呼吸链。研究人员通过活细胞成像和蛋白质组学研究发现,这些细胞的线粒体中都具有功能性的氧化呼吸链,只是活性较低。氧化呼吸链上包含5个复合体,他们发现如果抑制复合体II、III、IV和V(ATP合酶),细胞都会死亡;但是,如果用鱼藤酮来抑制复合体I,那么78%的I期卵母细胞都能存活,这显示这些细胞并不会利用复合体I。
其实,与其说不会利用,不如说不能利用:在非洲爪蟾的I期卵母细胞中,线粒体会尽量减少组装出有活性的复合体I。在这些细胞中,氧化呼吸链的亚基总体都在减少,但复合体I消耗得最快。
不过,复合体I并不会一直处于“缺失”状态。研究人员发现,随着非洲爪蟾的卵母细胞发育达到可以受精的状态时,复合体I也会逐渐组装完整。但随着其组装完成,细胞内ROS就会开始积累。从初期到晚期,这些卵母细胞中的氧化状态也会逐渐升高。
麻烦收拾下垃圾
7月16日,博克和同事再次在《欧洲分子生物学学会杂志》(The EMBO Journal)上发文,揭示了女性初级卵母细胞如何让内部废物处理系统失活,进而减少能量消耗,避免随之而来的氧化伤害。博克表示,“通过观察100多个新鲜捐赠的卵子,我们发现卵母细胞通过一种令人惊讶的极简策略,在多年内一直保持在原始的状态。”
在这次研究中,他们从西班牙巴塞罗那生育诊所Dexeus Mujer收集了21名19~34岁健康女性捐献的100多枚卵子。其中有70枚为已准备好受精的卵子,均为次级卵母细胞,处于减数分裂第二次的中期(MII),还有30枚为尚未成熟的初期卵母细胞。
他们利用3种不同的荧光染料(LysoTracker、TMRE和Me4Bpy)分别追踪了这些细胞中溶酶体、线粒体和蛋白酶体的活性。结果显示,相比于邻近的卵丘细胞,初期卵母细胞中溶酶体、线粒体和蛋白酶体活性低了约50%,并且随着卵母成熟达到MII时期,活性还会进一步下降。
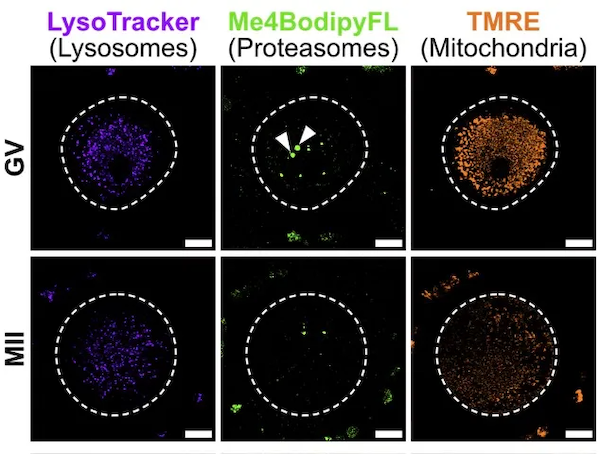
溶酶体和蛋白酶体是细胞两大废物处理系统中的关键部分。它们会降解细胞内不需要的蛋白质,但与此同时也会消耗大量的能量。这两者的活性降低,也意味着在卵母细胞中可能会积累很多不需要的蛋白质聚集体。随后,研究人员发现这些蛋白质聚集体会集中于一些体型更大的溶酶体中。
他们采用免疫标记的方式检测了分别处于溶酶体膜上和内部的各一种蛋白质。相比于初级卵母细胞,在次级卵母细胞中,溶酶体的活性和数量都明显降低。但在次级卵母细胞的细胞膜上,却发现了本应该只存在于溶酶体膜上的蛋白质。这也暗示这些细胞采取了一种简单的办法,通过胞吐作用直接将体内多余的蛋白质聚集体“扔”到了细胞外。
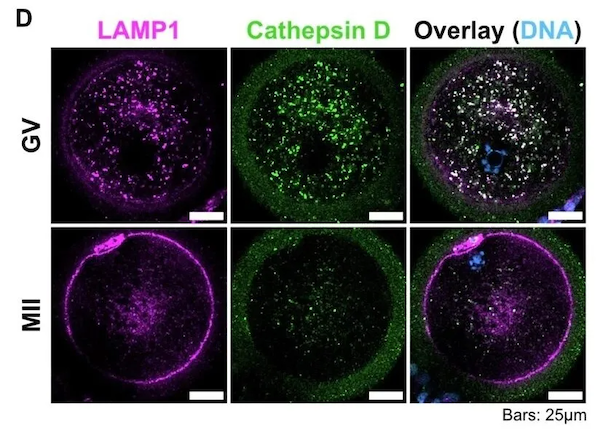
研究人员在活体成像中观察到了这些现象:在排卵前的最后几个小时,卵子将溶酶体中的内容物释放到周围的液体中。与此同时,线粒体和蛋白酶体也从聚集在细胞核周围,变成了均匀分布到细胞质之中。
论文的第一作者加布里埃莱·扎法尼尼(Gabriele Zaffagnini)表示,“这是一种此前完全不知的、人类的卵母细胞进行的大扫除。”他们认为,在卵母细胞的成熟时,降低细胞器活性或将可以保留对胚胎发育至关重要的关键的细胞成分。
这项研究中的发现将能帮助更好地判断卵细胞的状态,选择健康的卵子,进而提高全球每年数百万例试管婴儿(IVF)的成功率。博克表示,不孕不育的患者通常会被建议服用一些补充剂来改善卵子代谢,但通过观察新鲜捐赠的卵子,我们发现采用相反的方法,即维持卵子自然平静的新陈代谢,可能是保持卵子质量的更好方法。
参考链接:
https://www.embopress.org/doi/full/10.1038/s44318-025-00493-2
https://www.eurekalert.org/news-releases/1090932
https://news.ucr.edu/articles/2020/07/24/neurons-are-genetically-programmed-have-long-lives
https://www.nature.com/articles/s41586-022-04979-5
