撰文 | 黄雨佳
审校 | 王本 clefable
抗生素耐药性正在成为日益严峻的公共卫生挑战。据统计,仅2019年一年,全球就有近500万人的死亡与抗生素耐药性有关。其中,金黄色葡萄球菌是人类面临的三大致命细菌之一,每年会夺走超过100万人的生命。为了对抗耐药的金黄色葡萄球菌,医生有时不得不使用万古霉素等“终极抗生素”。可即使是这些被称为“最后防线”的药物,也已经开始出现失效的迹象了。
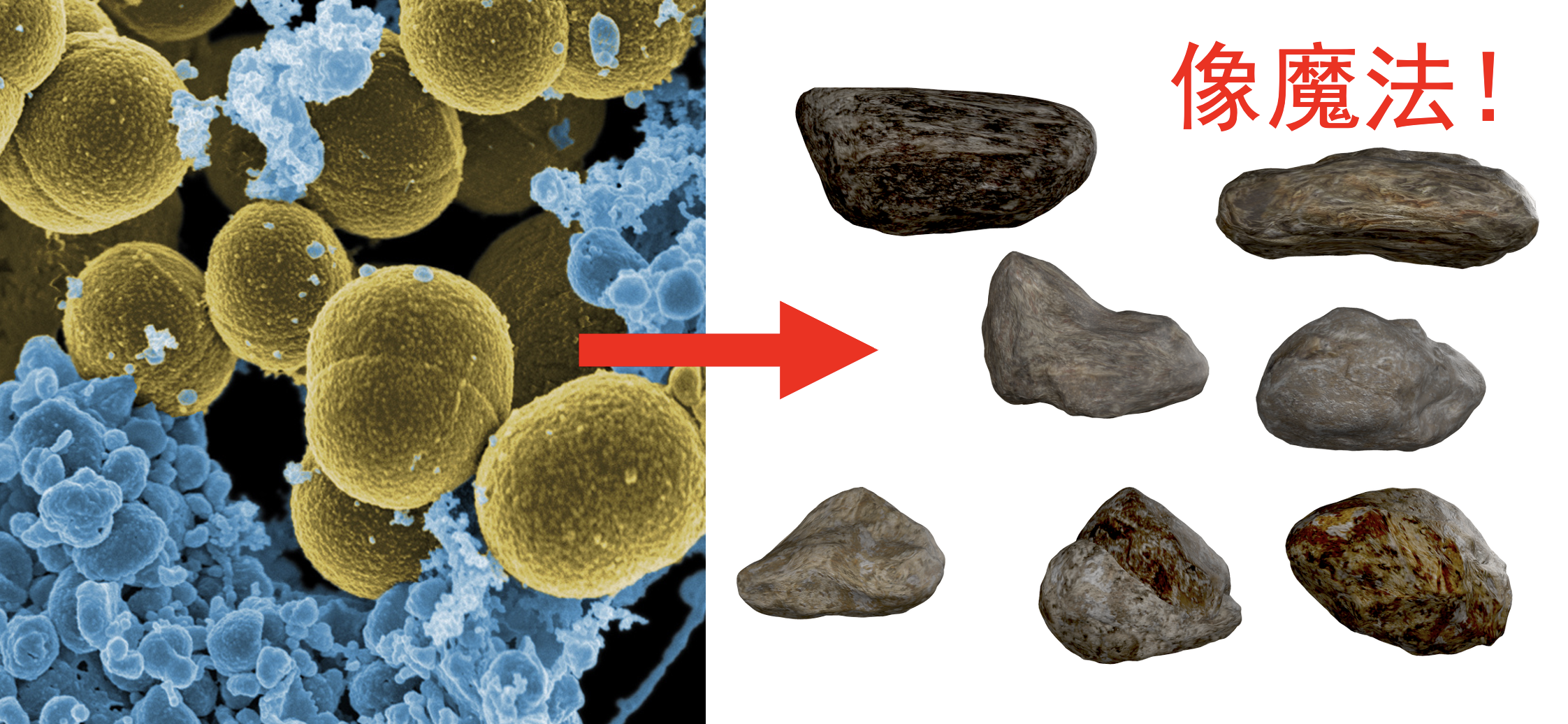
难道除了不断研发新抗生素之外,我们就束手无策了吗?在2025年7月发表于《自然·生物技术》(Nature Biotechnology)的一篇论文中,浙江大学王本课题组另辟蹊径,提出了一种前所未有的“剿灭”耐药菌的方法:诱导细菌钙化,让它们变成“石头”。
“统统石化”
这个奇妙的想法源于一个人们早已知晓的现象:慢性感染痊愈往往会伴随着钙化灶的出现。例如,许多肺结核痊愈患者的肺部会有钙化痕迹。王本形容道:“这些钙化灶就像战场遗址一样,意味着细菌已经被免疫系统清除。”
尽管科学家对钙化灶的形成机制尚不完全了解,但细菌钙化与疾病痊愈之间的紧密联系让王本产生了一个想法:如果能人为地让细菌在体内钙化,会发生什么?于是,王本找到了浙江大学附属第二医院的感染科主任徐峰,并安排博士生张婉莹一起将这个新奇的想法付诸实践。
王本希望借助人体本身的钙化机制来“石化”细菌。因此,他将目光投向了人体中最典型的钙化组织——骨骼和牙齿,它们的主要无机成分是磷酸钙。
事实上,我们体内充满了钙离子和磷酸根离子。在正常生理条件下,血液中钙离子的浓度约为2.5毫摩尔每升,磷酸根离子的浓度约为1毫摩尔每升。相比之下,其他微量元素的浓度通常都只有微摩尔级别。
有趣的是,这些钙离子和磷酸根离子并不会在体内随意沉积,它们的行为受到体内钙化蛋白质的严格调控。王本解释道:“许多钙化蛋白质都富含带羧基的氨基酸。这类结构能精准富集体液中的钙离子和磷酸根离子,引导它们形成磷酸钙沉积。”
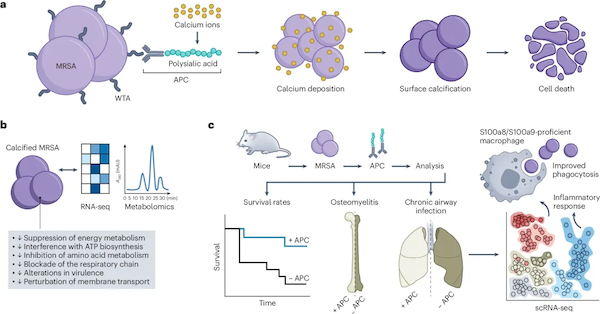
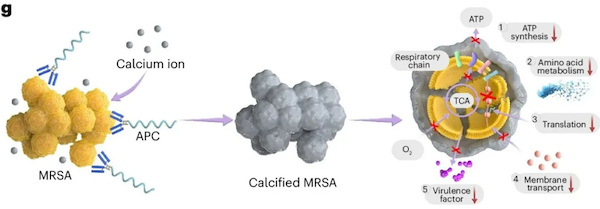
那么,如果能在细菌表面人为“种”上一层富含羧基的结构,是否也能像在骨骼和牙齿中一样诱导钙化呢?带着这个设想,王本团队设计了一种分子:他们在能够结合细菌细胞壁的抗体上,连接了一段富含羧基的聚合物——多聚唾液酸(PSA)。这种抗体-PSA偶联物(APC)理论上可以在细菌表面引发磷酸钙沉积。
研究人员将APC与从患者体内分离出的耐甲氧西林金黄色葡萄球菌(MRSA)混合在了一起,并在电子显微镜下观察。结果,这种致病菌表面竟然真的形成了一层严密的钙化晶体外壳!更重要的是,这层“石壳”几乎全方位地压制了细菌,让许多细菌都裂解而死。

王本说:“钙化降低了细菌整体的代谢水平,导致细菌无法分泌毒力蛋白,还切断了细菌之间的群体感应,这种杀伤和封堵是全方位的。”这些结果让他看到了“石化疗法”治疗感染的巨大潜力。
于是,研究团队开始尝试用“石化疗法”治疗由金黄色葡萄球菌引起的肺炎和骨髓炎。他们发现,经过一个月的治疗,慢性肺炎和慢性骨髓炎小鼠的病情显著改善。而且,如果在治疗期间配合高钙饮食,疗效还会更好。王本解释道:“高钙饮食本身并不会打破身体的钙离子稳态,但它会为钙化提供‘弹药’。弹药越多,细菌表面沉积的磷酸钙就越多,疗效自然越好。”
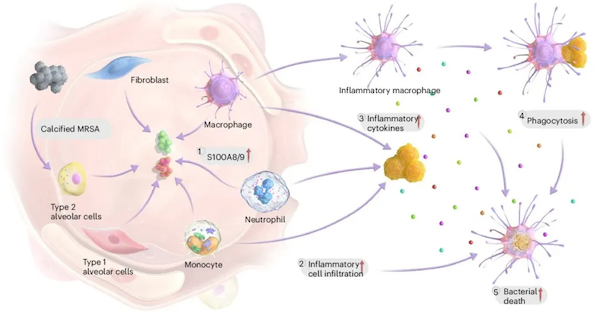
更令团队惊喜的是,钙化不仅会直接削弱细菌,还能增强机体免疫系统的战斗力。在钙化细菌的“呼唤”下,大量巨噬细胞会向感染组织进发,它们会吞噬钙化的细菌,还会分泌促炎细胞因子。王本将钙化的细菌视为炎症的“吹哨人”,因为它会召唤巨噬细胞前来“灭火”。
遗憾的是,“石化疗法”似乎无法治疗急性感染。研究团队试图用同样的策略治疗急性肺炎小鼠,却失望地发现,细菌表面并没有出现钙化晶体。王本推测,这可能是由于急性感染中细菌繁殖过快,数量庞大,环境中有限的钙离子和磷酸根离子无法在短时间内形成足够的钙化层,难以封堵细菌。“我们在体外实验中也看到过类似现象,”他说。
MRSA之外
值得注意的是,虽然这项研究中的抗体结合靶点是金黄色葡萄球菌特有的壁磷壁酸(WTA,一种特殊糖基化修饰的磷壁酸),但其实磷壁酸分子存在于非常多革兰氏阳性菌的细胞壁中。它们具有结构多样性,这也是革兰氏阳性菌演化适应性的体现。因此,王本推测,这种“石化疗法”可能具有一定的普适性:或许更换成其他细菌表面的特异性靶点,类似的方法也能用于对抗其他细菌感染。
事实上,这也并非王本团队首次尝试通过人为手段诱导细胞表面钙化。早在2021年,他们就在《德国应用化学》(Angewandte Chemie International Edition)上发表了一篇论文,验证了诱导癌细胞表面钙化的效果。研究显示,这种方法显著提高了宫颈癌和乳腺癌小鼠的存活率。至于“石化”的癌细胞是否和“石化”的细菌一样能高效激活免疫系统,王本则表示仍需深入研究,毕竟肿瘤的免疫微环境与细菌病灶截然不同。
此外,他们还曾将类似策略用于清除衰老细胞。在一篇2024年12月发表于《自然·衰老》(Nature Aging)的论文中,他们在一种能靶向衰老细胞的分子上连接了16个谷氨酸(同样带有羧基)。尽管研究团队并未观察到衰老细胞表面发生钙化,但这种方法成功激活了小鼠体内的自然杀伤细胞,有效地清除了衰老细胞。由此可见,诱导细胞表面钙化的策略或许并不局限于细菌,还可能在更广泛的医学场景中发挥作用。
不过,要真正将“石化疗法”用于临床,依然面临不小的挑战。例如,目前研究团队用于清除耐药菌所需的APC剂量依然偏高。虽然实验中的小鼠并未出现明显不良反应,但他们确实检测到小鼠体内产生了针对APC的抗体。王本表示,未来他们还要进一步优化分子结构,降低APC的免疫原性,同时提升其稳定性,从而减少给药剂量。
此外,“石化疗法”也并非耐药细菌的终极解法。如果细菌发生突变,使APC中的抗体无法有效结合,那么新的耐药性依然可能出现。正如王本所言,人类与耐药细菌的博弈是一场永无止境的“矛与盾之战”,我们不能奢望只用一种方法就能彻底解决所有问题。但是,这样的策略未来仍然可能与其他疗法相辅相成,为人类在与耐药细菌的拉锯战中赢得新的筹码。
参考链接:
https://www.nature.com/articles/s41587-025-02736-3
https://onlinelibrary.wiley.com/doi/10.1002/anie.202016122
https://www.nature.com/articles/s43587-024-00750-9