
撰文 | 黄雨佳
审校 | clefable
在我们的皮肤和上呼吸道中,大量分布着一种名为金黄色葡萄球菌(Staphylococcus aureus)的微生物。通常情况下,这些细菌能与我们和平共处。然而,当我们的皮肤受损时,它们就可能导致皮肤红肿、起水泡和脓疮。如果我们食用了受其污染的食物,就可能出现中毒。由于免疫力变差、服用免疫抑制剂或感染流感等,免疫系统屏障变得脆弱的患者还可能发生肺炎。一旦大量的金黄色葡萄球菌进入血液,就可能感染几乎任何器官,严重时甚至导致多器官功能衰竭和死亡。
这种细菌最早于1880年发现。那时,中重度金黄色葡萄球菌感染患者的死亡率高达80%。直到1928年,亚历山大·弗莱明(Alexander Fleming)发现的青霉素,迅速将这种感染的死亡率降低至20%。然而,金黄色葡萄球菌很快就对青霉素产生了耐药性。
根据世界卫生组织2022年的数据,在全球所有感染金黄色葡萄球菌的患者中,感染耐甲氧西林(一种青霉素类抗生素)金黄色葡萄球菌(MRSA)的占比中位数水平已经达到了35%。与非耐药性的金黄色葡萄球菌感染患者相比,MRSA感染患者死亡的可能性高出了64%。仅2019年一年,金黄色葡萄球菌感染就导致全球超过100万人死亡,威胁着全世界每个人的生命和财产安全。
为了应对MRSA感染难以治疗的困境,过去几十年,研究人员一直在试图开发针对金黄色葡萄球菌的疫苗。他们一般采用两种策略来设计疫苗,一种针对金黄色葡萄球菌表面的成分,另一种则针对它产生的毒素。许多疫苗在动物实验阶段都取得了良好效果,十几种疫苗接连进入II期和III期临床试验阶段。然而,无论基于哪种策略设计的疫苗,最终都会以无法预防金黄色葡萄球菌感染、无显著疗效的结局告终。
这种同一种疫苗在动物和人身上出现截然不同效果的现象,令科学家疑惑了多年。部分研究人员猜测,这可能是因为小鼠与人类的免疫反应存在某些差异。另一些人则认为,我们平时能与金黄色葡萄球菌和平共处,将它视作正常菌群的一部分,这也说明人体在演化过程中,已经极大降低了对金黄色葡萄球菌产生免疫反应的可能性。然而,究竟是什么原因,学界一直都没能明确答案。直到最近,美国加利福尼亚大学圣迭戈分校(UCSD)的研究人员才终于揭开背后的奥秘。
无效的疫苗
UCSD的研究人员猜测,这些金黄色葡萄球菌疫苗之所以失败,是因为它们只能激活人体内早已存在的、对金黄色葡萄球菌的体液免疫。高达50%的人早在2个月大时就开始接触金黄色葡萄球菌,正常人的血液中已有一定滴度的抗金黄色葡萄球菌抗体。而这种抗体并不能防止我们发生感染,这说明它不具保护效力。金黄色葡萄球菌疫苗可能只是让我们生产了更多“垃圾”抗体。相反,动物实验用的小鼠模型在接种疫苗前并未与金黄色葡萄球菌打过交道,因此疫苗起到了良好的效果。
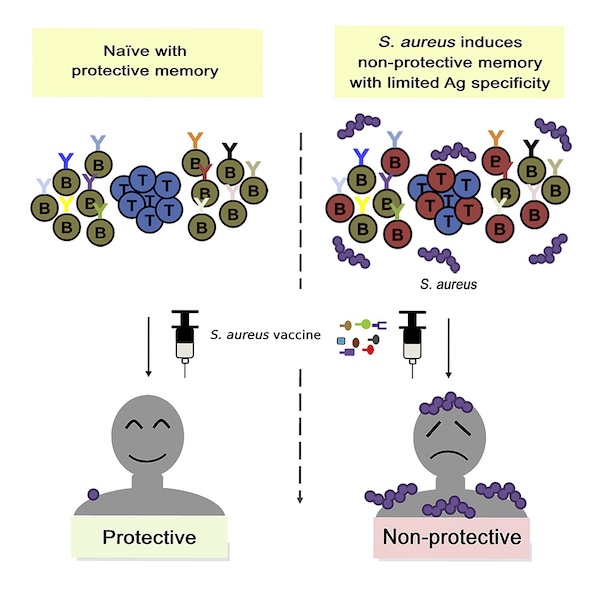
为了验证这一猜想,研究人员选择了史上“最为失败”的一款金黄色葡萄球菌疫苗——V710,进行实验验证。V710由默沙东和Intercell公司联合开发,针对的是金黄色葡萄球菌表面一种名为“铁调节表面决定簇蛋白B”(IsdB)的分子。2007年,V710进入临床试验,预期能预防患者在心胸外科手术后出现的严重金黄色葡萄球菌感染。出乎所有人意料的是,接种安慰剂的患者感染金黄色葡萄球菌后的死亡率仅为4.2%,而V710接种者感染后死亡率直接达到了23.0%,高出对照组5倍以上。考虑到安全性问题,该临床试验很快被叫停。
为了模拟V710在人体中产生的效果,UCSD的研究人员通过每周让小鼠感染金黄色葡萄球菌1~3次的方式,来模拟人体在接种疫苗前对病原体的反复接触,然后,再用与V710试验中相同的策略,给小鼠接种疫苗。实验结果明确提示,接种疫苗之前的接触让原本能保护小鼠的疫苗变得无效了。
可明明是同样的疫苗,为什么在感染金黄色葡萄球菌前后接种的效果会产生区别呢?研究人员比较了两种情况下小鼠产生的抗体,他们发现,两种情况下小鼠产生的针对金黄色葡萄球菌的抗体滴度并无差异,甚至先感染而后接种疫苗的小鼠产生的抗体针对IsdB的亲和力更高。
但是,感染后接种疫苗产生的抗体激活免疫细胞吞噬金黄色葡萄球菌的能力更差,而且抗体中针对IsdB的识别区域较为有限,而直接接种疫苗的小鼠则能产生大量识别区域更多样的抗体。此外,在感染后接种疫苗的小鼠中,那些原本可能有效的抗体,还会因不得不与大量“垃圾”抗体竞争结合IsdB,最终彻底失效。
制备疫苗的新思路
基于这些结果,研究人员提出了一种规避此前已经存在的免疫印迹、使疫苗发挥效用的思路:疫苗失效是因为其选用的成分免疫原性很强,激活了强大的免疫记忆,表达出高滴度的抗体;如果选用免疫原性稍弱的抗原,即“次显性抗原”(subdominant antigen)制备疫苗,就可能解决这一问题。
于是,研究人员找到了一种小鼠哪怕感染3倍剂量的金黄色葡萄球菌,仍只能诱导较低抗体滴度的蛋白质——凝集因子A(ClfA),作为疫苗的候选成分。然后,他们将ClfA与免疫佐剂(能增强机体对抗原免疫应答的物质)共同注射到小鼠体内。
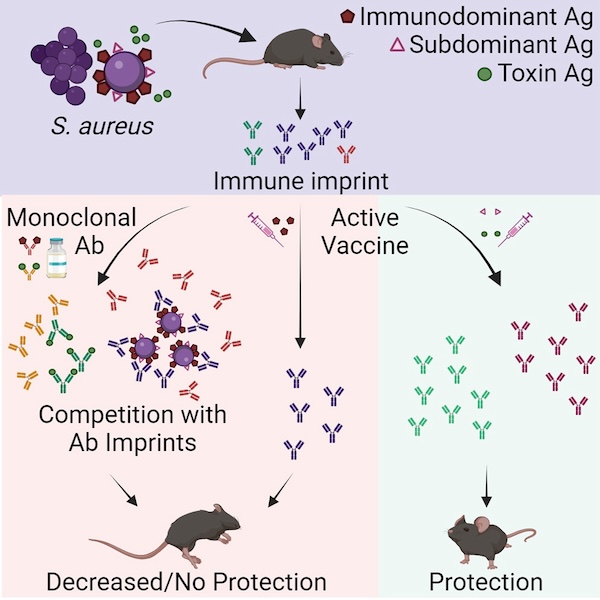
结果,无论小鼠此前是否接触过金黄色葡萄球菌,都产生了大量的特异性抗体,而这些抗体并不会出现在已感染过金黄色葡萄球菌的小鼠体内。实验结果也证实,这些特异性抗体具有保护作用。利用另外两种次显性抗原——SdrE和EsxAB制备的疫苗也产生了类似效果。
这些实验结果为研究人员未来开发新的金黄色葡萄球菌疫苗提供了方向:使用未接触过金黄色葡萄球菌的小鼠开发疫苗是没有意义的;针对金黄色葡萄球菌细胞壁相关抗原设计的疫苗也会无效,应该针对毒素或是同时针对毒素和细菌的表面抗原来设计疫苗;此外,还应针对此前人体不具备免疫印迹的次显性抗原,来开发疫苗。
研究人员指出,由于人体内针对金黄色葡萄球菌的抗体滴度会随着与细菌的接触逐年升高,因此针对毒素设计的疫苗或许在婴儿和儿童中的效果会更好,而老年人则更应接种针对次显性抗原设计的疫苗。
不过,金黄色葡萄球菌疫苗的开发还有很长的路要走,我们只能慢慢等待了。
参考链接:
https://www.msdmanuals.cn/home/infections/bacterial-infections-gram-positive-bacteria/staphylococcus-aureus-infections
https://www.mdpi.com/2076-2607/8/12/1936
https://www.who.int/zh/news/item/09-12-2022-report-signals-increasing-resistance-to-antibiotics-in-bacterial-infections-in-humans-and-need-for-better-data
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(22)02185-7/fulltext
https://www.cell.com/cell-chemical-biology/fulltext/S2451-9456(22)00159-3
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(23)00577-3
https://onlinelibrary.wiley.com/doi/full/10.1111/1469-0691.12570
https://jamanetwork.com/journals/jama/fullarticle/1674236
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(22)00311-0
