
撰文 | clefable
审校 | 黄雨佳
对于一些有着“远大抱负”的病菌而言,掌握一些简单但关键的物理知识必不可少。鼠疫耶尔森菌(Yersinia pestis)是一种重寄生生物,它寄生于寄生在鼠类的跳蚤身上,十分擅长利用跳蚤在鼠类和人群中传播。
它拥有的物理技巧是利用血液的回流感染新宿主。它们会在跳蚤的前胃处形成生物膜,将它们吸入的血液堵在那里。这会让跳蚤十分饥饿,只能继续寻找宿主吸血,并在吸血时更用力。而这些新鲜的血液吸入时会撞击堵塞的鼠疫耶尔森菌,混合着它们形成反流。这会刺激跳蚤的“呕吐反射”,它们会将部分血液带着鼠疫耶尔森菌“呕吐”出去,从叮咬的创口进入宿主体内。
近年来,一些考古学研究发现,这种病菌从新石器时代晚期就开始感染人类,其高毒性的毒株首次出现于距今3800年前。不过我们真正了解这种病菌的时间要晚得多:人类直到经历了惨痛的查士丁尼鼠疫(Plague of Justinian,即第一次鼠疫大流行)和黑死病(即第二次鼠疫大流行的早期)之后,甚至到了第三次鼠疫大流行,才得知这些大流行的元凶都是鼠疫耶尔森菌。
3次标志性的大流行
第三次鼠疫大流行开始于1855年。当时正是清朝的咸丰五年,鼠疫在云南地区出现后开始扩散。1894年,广州暴发鼠疫,导致约8万人死亡,随后香港又出现了严重的疫情。不同于流感等通常短时期暴发的疫情,鼠疫并没有就此消散,而是在此后数十年内持续暴发,最终导致香港地区超2万人死亡。同一时期,鼠疫又随着当时的全球航线蔓延到了世界各地,印度和中国的死亡最为惨重,累计数百万甚至数千万人。哪怕是如今在乌干达、刚果、美国和蒙古等国出现的鼠疫,依然被认为是这次大疫情的遗留。
同样是在1894年,日本的科学家北里柴三郎和瑞士裔法国细菌学家亚历山大·耶尔森(Alexandre Yersin)分别到香港采集了病理样本,并确认了鼠疫由鼠疫耶尔森菌引发。4年后,另一位法国医生保罗-路易·西蒙德(Paul-Louis Simond)发现鼠疫之所以能从老鼠传播给人类,离不开在受感染老鼠体表寄生的的印度客蚤(Xenopsylla cheopis)。鼠疫在人群中的暴发,一般最先出现在人群密度大、卫生条件差,以及老鼠大量出没的街区,而且一般是在老鼠快要死绝时——因为这个时候,鼠疫耶尔森菌需要新的宿主。
往前追溯,更早的两次鼠疫大流行让人类付出的代价似乎更加巨大,达到了颠覆经济和文明发展的程度。第一次鼠疫大流行持续了超过2个世纪,当时欧洲有一半的人都死于这次疫情。第二次大流行则开始于至今都让人们不寒而栗的黑死病(黑死病时期是从1346年到1353年),并持续了近500年的时间。黑死病作为人类历史上死亡人数最多的事件,席卷了欧洲、西亚和非洲。据估计,当时欧洲人口的总体死亡率约为30%以上,死亡人口约2500万人。

鼠疫被称为“黑死病”(the Black Death),更多是一种文学象征:“黑色”通常被用来描述死亡,而“黑死病”则深刻体现了鼠疫的急性致死性。不过,这一描述也十分符合一部分感染者的遭遇。败血症型鼠疫(Septicemic plague,鼠疫的3种感染形式之一)会导致弥漫性内血管凝血,患者会出现口腔、鼻子和肠道出血,皮下出血,四肢和组织坏死的情况,四肢和身体上出现大面积可怕的黑斑,而且死亡率接近100%。不过,这种情况相对少见。更多患者感染的是腺鼠疫或肺鼠疫,但当这些感染发展得十分严重的时候——病菌直接冲破淋巴结和肺部的阻碍,大量进入血液,也会快速引发败血症。

每次鼠疫大流行时,腺鼠疫都是最先出现且最主要的感染形式。经由跳蚤叮咬,鼠疫耶尔森菌在进入人的皮肤后,会首先感染附近的淋巴,进而引起腺鼠疫。除了发烧、呕吐和疼痛等症状,患者身体多处的淋巴结会十分明显地肿大,死亡率达40%~60%。
肺鼠疫主要由腺鼠疫或者败血症型鼠疫(血液中的病菌也可以进入肺部造成感染)发展而来,也可能由患者直接吸入有致病菌的飞沫引起。患者会出现胸痛和咳血等症状,其死亡率也为100%。虽然不如败血症型鼠疫发展迅猛,但肺鼠疫却极具传播性。一些研究发现,黑死病能在短短5年内造成数千万人死亡,其原因或是发展出了人传人的肺鼠疫。
随着历史上的疫情情况被逐渐复现,一些科学家开始将视线聚焦于一个新的问题:追溯每一次鼠疫耶尔森菌的来源,或者说在三次大疫情之间,这种病菌如何消退又兴起。今年5月29日,在一项发表于《科学》(Science)的研究中,法国巴斯德研究所和加拿大麦克马斯特大学的研究人员合作发现,第一次和第二次鼠疫大流行中的病菌都来自啮齿动物。造成第一次大流行的病菌毒株没有留下任何后代;不过,第二次大流行的毒株形成了两个主要的演化分支:一支演化出了导致第三次大流行的菌株的祖先,另一支在几个世纪内反复在整个欧洲暴发,最终于19世纪初灭绝。
鼠疫的兴衰之谜
鼠疫耶尔森菌是一种球杆状的细菌,无法运动,看起来单纯、无害。不过,它们可以形成抗吞噬的黏液层,进而通过宿主的“呕吐”传播。该病菌的高致病性与其基因组上的一个致病岛和体内的3种质粒密切相关。其中多个基因表达的蛋白质之间会协同合作,增强病菌的毒性、传播性,帮助其躲避人体免疫,入侵并破坏人的淋巴结和肺部。
在《科学》的这项研究中,研究人员重点关注了其中pPCP1质粒上的pla基因。pla基因表达的蛋白质就像一把犀利的斧头,能为鼠疫耶尔森菌“开路”。这种蛋白质可以将人和动物体内的纤溶酶原转化为纤溶酶,而纤溶酶会降解人组织中的纤维蛋白和细胞外基质,让病菌可以从皮肤扩散到淋巴结,引发腺鼠疫。据一项2015年发表于《自然·通讯》(Nature Communications)的研究,pla基因也让这种病菌可以在动物的肺中快速繁殖,导致致命的肺鼠疫。
麦克马斯特大学的研究人员在分析了数百份古代鼠疫受害者的样本后,有了一些特别的发现,那就是在第一次和第二次鼠疫大流行后期流行的病菌中,pla基因的拷贝数均有所下降。在第一次大流行中,有30%的病菌出现了pla基因数量减少的现象,在第二次大流行中,这一比例为51%。这些发现显示,似乎在大流行开始的数十年或一个世纪之后,就会开始出现pla基因减少的病菌毒株。该论文的作者之一、麦克马斯特大学古代DNA中心主任亨德里克·波伊纳尔(Hendrik Poinar)提到:“这项研究是首批直接检查古代病原体变化的研究之一,这种病原体我们至今仍能看到,我们试图了解是什么导致了鼠疫大流行的毒性、持久性和最终的灭绝。”
为了验证在古代毒株中的观察,法国巴斯德研究所的研究者则测试了这家研究所收藏的、第三次鼠疫大流行的病菌样本。他们筛选了2335份现代病菌样本,发现在野生病菌中,含pla基因的质粒数量可以多达9个,而在pla基因数量减少的病菌,数量会下降到1~2个。随后,他们测试了不同pla基因缺失程度的病菌毒株感染小鼠的情况,包括pla基因数量减少了90%的毒株,缺失数量处于中间水平以及未缺失pla基因的菌株。研究显示,后两组菌株感染小鼠后,小鼠的死亡率为100%,而第一组仅为85%。而如果小鼠感染的菌株完全没有pla基因,则死亡率则只有7%。
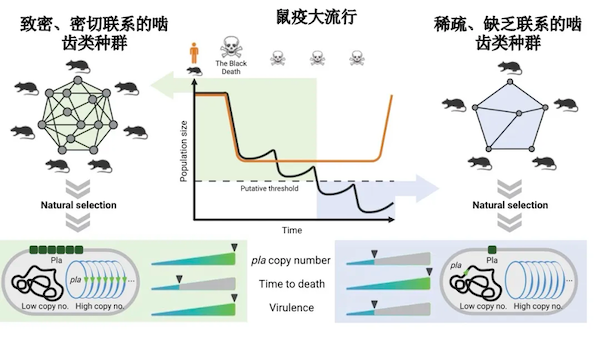
所以,其他的pla基因去了哪里呢?研究人员进一步发现,pPCP1质粒可以帮助pla基因整合到病菌的基因组中,在古老的毒株中似乎也有类似的情况。这也解释了为何古代和现代的鼠疫耶尔森菌样本,都出现了质粒中pla基因数量减少的情况,而pla基因一旦整合到基因组中,就会无法发挥作用,宿主的死亡率就会降低,这也解释了鼠疫的消亡。
一个残忍的事实
结合这种病菌的传播方式来看,它会主动降低自身的致命性,这似乎并不合理。正如上文所言,鼠疫耶尔森菌的传播,需要靠最初的宿主尽快到达接近死亡的严重败血症时期,这样受感染的跳蚤会放弃旧宿主,寻找新宿主并传播病菌。而pla基因减少势必会让病菌的毒力减弱,宿主存活时间延长,进而降低总体的传播率。
然而,之所以会出现这种看似不合理的现象,其原因其实存在于关于鼠疫时期的记载之中。最初,高致死性的病菌确实会在鼠类中迅速且大规模地传播,随着鼠类大量死亡,病菌又会像飓风一样划过密集的居民区,收割人类的生命,并通过腺鼠疫和肺鼠疫快速传播。就像在黑死病期间,短短5年内,欧洲的人口数量一度减少了约30%至50%,而此后十年一次的鼠疫暴发,一直让当时的人口数量维持在较低水平。另一方面,在野生草原环境中,由于鼠疫,鼠类的死亡率也高达95%以上。
在最初的一个世纪里,鼠疫不断向感染的动物宿主和人类挥下镰刀,就像筛子一样滤过易感人群,而为了躲避死亡,宿主们也会日益分散。在这样的环境下,高毒性的病菌将无以为继,因为它们杀死了旧宿主,又再也没有了新宿主来填补传播链条。而只有那些毒性更低的毒株才能潜伏在鼠群之中,等待鼠群和人群的数量再一次复苏,方可以挥舞下一次的镰刀。在论文中,研究人员用流行病倦怠模型(models of epidemic burnout)解释了这一现象:病原体不得不衰减到可以在小规模的种群中持续存在,以维持传播,以便等种群恢复后,重新引发流行病。
庆幸的是,就在1894年,人类的命运出现了转机。科学家发现了鼠疫耶尔森菌,并进一步发现了它的传播模式,并在后续的考古学研究中,进一步揭开了其身为前两次鼠疫大流行的凶手身份。这一切又推动了科学家开发治疗鼠疫的方法,将人类从这个持续威胁数千年、残酷且黑暗的死亡循环中解救了出来。
1943年,美国微生物学家艾伯特·沙茨(Albert Schatz)和塞尔曼·瓦克斯曼(Selman Waksman)从灰色链霉菌中分离出了链霉素,这种化合物成为了首个治疗鼠疫的药物,其对3种鼠疫感染类型均有效。在这之后,科学家又开发了一些副作用更小的抗生素,并开发了针对鼠疫的疫苗。截至目前,虽然第三次鼠疫大流行的余烬仍在,但科学家还在开发更为前沿的DNA疫苗和病毒载体疫苗,以为人类提供更全面的保护。
参考链接:
https://www.pasteur.fr/en/press-area/press-documents/plague-bacillus-became-less-virulent-prolonging-duration-two-major-pandemics
https://www.nature.com/articles/ncomms8487
https://en.wikipedia.org/wiki/Plague_of_Justinian
https://www.britannica.com/event/Black-Death
https://www.britannica.com/science/plague
https://en.wikipedia.org/wiki/Black_Death
https://www.who.int/en/news-room/fact-sheets/detail/plague
https://www.eurekalert.org/news-releases/1085102
https://www.science.org/doi/10.1126/science.adt3880
