
图片来源:Unsplash+
撰文|clefable
审校|冬鸢
虽然只是动物体内最小的细胞之一,但精子从诞生时就被委以重任——参与形成下一代。或许是由于这个任务十分艰难但极为重要,自然演化让很多动物中的雄性在进入性成熟之后的很长时间,可以持续产生大量精子。
人类也是其中的一员。据悉,一位健康的男性在一生中可以产生数千亿至数万亿个精子(而一个成年男性的体细胞总数大概在40万亿个左右)。这也让他们在高龄时,仍有成为父亲的可能。但是这对于他们的后代而言,可能并不是一件好事。
已有很多关于动物和人类的研究证实,由高龄父亲精子孕育的后代,寿命会更短,且衰老的特征也会更明显。2023年,一篇发表于Maturitas的论文研究了清代高龄男性后代的寿命,发现在那个饮食匮乏和医疗落后的时期,男性的年龄超过35岁后,下一代的预期寿命或会缩短。

图片来源:Unsplash
关于高龄父亲会如何影响后代寿命和健康,德国神经退行性疾病中心的科学家在发表于PNAS的论文中表示,在高龄小鼠父亲的后代中,一个关键的营养信号感知通路——mTORC1信号通路会过度活跃。
它的活跃会让细胞清理垃圾的能力降低,干细胞的功能会下降且会出现枯竭等。不过,一些研究还证实,采用雷帕霉素直接抑制这个通路,可以减缓小鼠的衰老进程。
去年10月,一项发表于《自然》(Nature)的研究则显示衰老会导致精子DNA中的有害突变增加。这项研究发现人类男性在30岁出头时,每50个精子中大约有1个携带致病突变,而年龄一旦达到70岁,携带致病突变的精子数量会增加2.5倍。
近年来,该领域的科学家开始愈发关注精子头部的另一种核酸分子——RNA。近期,在一项发表于The EMBO Journal杂志中,犹他大学的研究人员发现在男性精子中存在一个RNA“衰老时钟”,可以判断精子的衰老情况。
精子的RNA变化,真能导致衰老!
精子就像是一个传递父亲遗传信息的“精简包裹”。这些信息集中于它们的头部,但不仅是细胞核内的DNA,研究人员发现细胞核内部和周围的RNA也会影响后代,具体是指小非编码 RNA(sncRNA)。
部分小非编码 RNA曾被发现可以保留父亲经历的一些环境线索,比如遭受的压力、高脂高糖饮食,并通过精子传递给子代,影响它们的发育和健康等。去年5月,一篇由瑞典林雪平大学的科学家发表于《自然·通讯》的论文发现,男性精子中的两种小非编码RNA——miRNA和核糖体小RNA数量,分别与子代胚胎的质量呈正相关和负相关。
图片来源:Unsplash+
相比之下,犹他大学的研究人员借助了他们开发的PANDORA-seq技术,探究了小鼠和人类精子的整个生命周期中的所有sncRNA种类。相比于已有的小RNA测序技术,PANDORA-seq可以检测一些经过修饰后的tsRNA和rsRNA。
这两种分子来自于我们十分熟悉的、参与蛋白质翻译过程的tRNA(读取密码子和转运氨基酸)和rRNA(构建核糖体),是它们酶切形成的小片段。另外,精子的“长途旅行”还有需要大量的线粒体为其供能,而线粒体作为一个单独拥有DNA的细胞器,也会在精子内留下tsRNA和rsRNA。这些小片段中部分具有调控基因表达和翻译的功能。
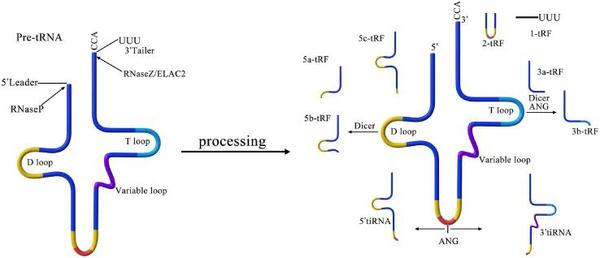
tsRNA前体经过酶切后产生的多种sncRNA 图片来源于论文The function of tRNA-derived small RNAs in cardiovascular diseases
为了分析小鼠精子的衰老过程,研究人员从小鼠的附睾尾部获得了成熟精子,并进行了RNA测序。在实验中,共有5个年龄组(10周、30周、50周、70周和90周龄)、每组4只共20只小鼠奉献了自己的精子。
通过分析测序获得的精子头部的所有种类tsRNA和rsRNA后,他们发现在50周(类似人类的40~50岁的男性)至70周龄(类似人类的55~65岁)小鼠之间存在一个明显的“衰老断崖”过程,可以将10-50周龄和70-90周龄的小鼠精子明显区分开。
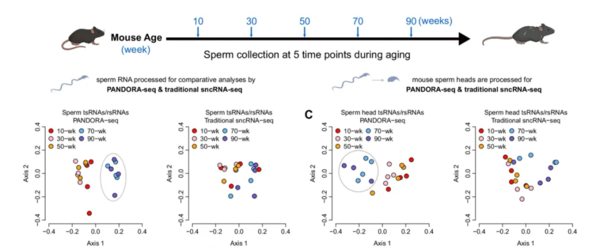
从图片下方的4个坐标图中,我们可以明显看出,犹他大学的科学家采用PANDORA-seq技术测的、小鼠精子前3个年龄组和后两个年龄组中的两种sncRNA可以明显分开,不会聚集在一起。这显示它们的数量和种类存在较大差异。图片来源于论文
其中变化最明显的是rsRNA,它的数量也最多(占比超过了70%)。研究发现,相比于更年幼的小鼠,年长小鼠中较长的rsRNA的相对丰度会增加,而较短rsRNA的丰度却会减少——研究人员将这种变化称为衰老指数(Ia)。
在论文中,他们提到这类长度变化显示,衰老的精子将较长的rsRNA加工成较短片段的能力在下降。而tsRNA在总体上并没有出现类似的、与年龄相关的长度变化模式。值得一提的是,虽然线粒体来源的rsRNA数量较少,但也存在相同的变化。
实际上,尽管线粒体来源的tsRNA和rsRNA在精子中的数量非常低,但研究人员发现它们的变化仍然可以与基因组来源这两类分子的变化相呼应,能用于有效区分不同年龄组的精子衰老状态。
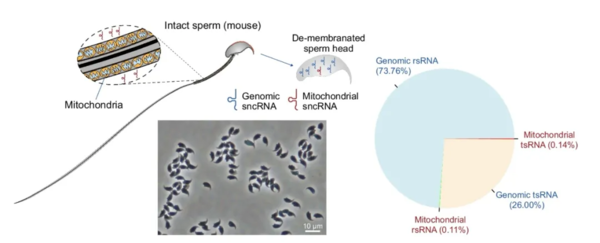
精子线粒体的尾部存在很多线粒体,而其头部会有一些线粒体来源的sncRNA,不过精子头部数量最多的仍是基因组来源的sncRNA,图片来源于论文
为了验证这两类分子确实能导致衰老,他们直接提取了在小鼠衰老过程中,精子中变化最大的tsRNA和rsRNA。随后,他们将这些代表 “衰老”的混合物,转染到一些小鼠胚胎干细胞中。这些细胞和早期胚胎细胞很类似,很可能会受到这些精子来源的RNA的影响。
事实也的确如此!在被引入“衰老”混合物的胚胎干细胞中,参与代谢通路(例如脂肪酸代谢、糖酵解等)、线粒体功能(氧化磷酸化、线粒体自噬)以及与神经退行性疾病(例如帕金森病、阿尔茨海默病等)相关的基因都出现了上调。这也提示后代患代谢和神经系统疾病的潜在风险提高。
其他论文也发现了相似的结论,显示衰老精子的后代,或者向受精卵中注射衰老精子RNA而孕育的后代,确实具有类似的疾病特征。
人类男性也逃不出相似的命运
虽然在小鼠中证实了这个“断崖衰老”现象的存在,但在人类男性中是否也是如此还需要验证。

图片来源:Unsplash+
因此研究人员继续推进了这项研究,他们收集了来自两项研究的男性精子样本,第一项研究有8位捐献者(年龄范围为34至68岁),每个捐献者会提供两份精子样本,中间间隔6~23年。而后一项研究,包含了47名年龄在25~51岁之间的捐献者提供的精子样本。
研究人员从这些样本中分离出了精子头部的RNA并进行了测序,发现了相似的现象:男性精子的衰老也会出现明显的rsRNA长度变化。
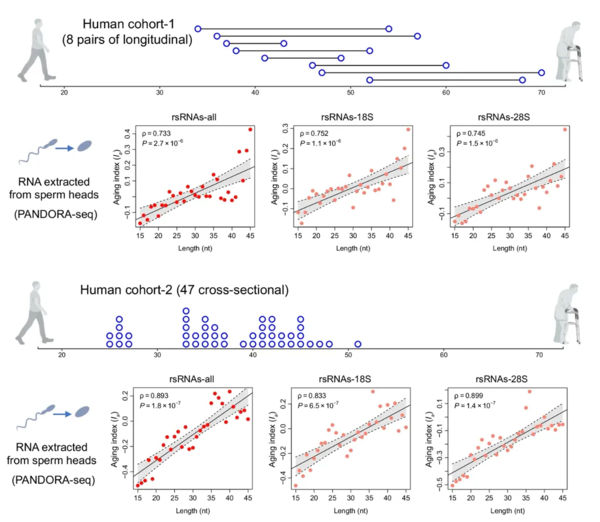
图片来源于论文
这也与小鼠中的一个发现形成了呼应。而研究人员推测,在男性的衰老过程中,rsRNA长度变化一直都在稳步进行,最终这些细微变化日积月累,变成了我们可以观察到的明显改变。他们还推测,这很可能是由累积的氧化应激所导致。实际上,精子的衰老会导致线粒体功能改变,和氧化应激积累等。已有充分证据表明,氧化应激会调节一些核糖核酸酶的募集和活性,进而控制tRNA和rRNA形成小的片段。
这个过程的改变会影响这些RNA的生物合成和后续的加工,并重塑“精子RNA密码”。 研究人员发现,尽管精子整体在50周到70周会出现一个“衰老悬崖”,但一些精子中的tsRNA和rsRNA的水平确实是在逐渐变化,因此可以作为精子的一个衰老时钟。
2019年,一项发表于《自然·医学》(Nature medicine)的研究曾显示,根据人体内的血浆蛋白变化,人体会出现三波衰老,分别是在34岁、60岁和78岁。而作为人体内的关键细胞,精子衰老是否和人体整体衰老有关,还需要更深入的探究。
这些分子变化是会在某个年龄阶段突然发生?或者,一些细小的渐进性变化可以作为“先导信号”,为日后更大的转变奠定基础?而精子中tsRNA和rsRNA会如何影响后代的发育,这些机制都有待研究。另一方面,关于预防衰老的研究,也在蓬勃发展。
备注:本文仅作为前沿科学发现分享,不提供更多建议。参考链接:https://www.eurekalert.org/news-releases/1112859
https://link.springer.com/article/10.1038/s44318-025-00687-8#auth-Qi-Chen-Aff1-Aff2-Aff3
https://www.nature.com/articles/s41467-025-62015-2
https://www.pnas.org/doi/10.1073/pnas.1707337115
https://www.sciencedirect.com/science/article/abs/pii/S0378512222002316
